實現快速功能補償與機械穩(wěn)定以治療急性肝衰竭
肝臟作為重要代謝器官,細胞密度高且結構復雜。在肝臟組織工程領域,肝移植供體稀缺,利用細胞封裝水凝膠治療急性疾病成為研究熱點。構建含高細胞密度且具備有效血管網絡的組織至關重要,這能實現快速功能補償,滿足代謝需求。
然而,當前面臨諸多難題。傳統用于封裝高密度細胞的水凝膠機械性能不足,難以承受生理血流剪切力,導致植入失敗;多數研究依賴宿主血管自然生長或吻合,速度慢,無法防止大規(guī)模合成組織缺血性細胞死亡;實現生理相關細胞密度困難,現有3D打印研究的細胞密度遠低于天然組織,且高細胞密度會影響生物墨水的可打印性和細胞活力。
為解決這些痛點,來自中國科學院動物研究所的顧奇教授團隊開發(fā)了一種微凝膠 - 水凝膠雜化材料(GMMHM),通過優(yōu)化微凝膠與生物大分子比例,形成的共價交聯網絡具備良好機械完整性,可進行直接血管吻合。該雜化材料支持多種功能,如嵌入式3D打印構建宏觀血管網絡、促進內皮細胞自組裝形成微血管網絡等。研究成果以“A Microgel–Hydrogel Hybrid for Functional Compensation and Mechanical Stability in 3D Printed Cell-Dense Vascularized Liver Tissue”為題發(fā)表在《Advanced Materials》上。

研究內容
1. 設計微凝膠-水凝膠雜化材料,通過制備不同成分比例的水凝膠并進行表征測試的研究方法,研究微凝膠-水凝膠雜化材料(GMMHM)的設計與特性。結果顯示,該雜化材料具備獨特的交聯結構和孔隙特征,其彈性模量、韌性等機械性能可通過調整HA-MA和GMM濃度優(yōu)化,能平衡生物相容性和機械性能。
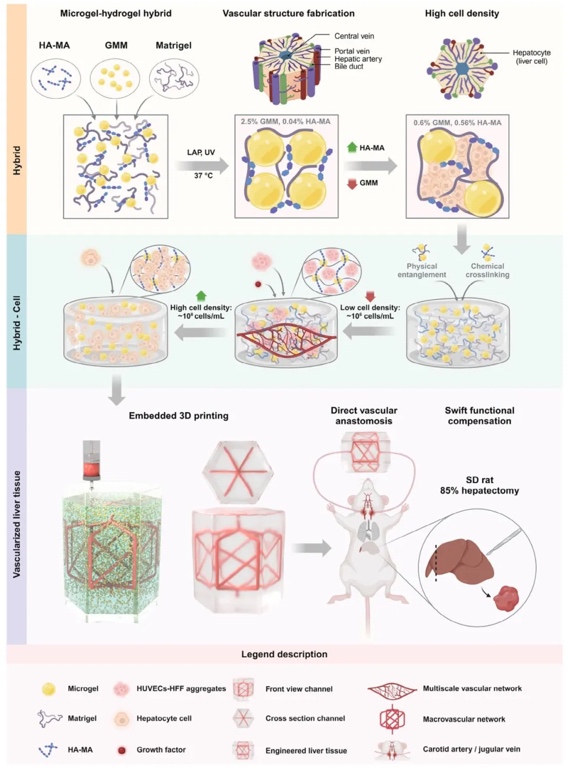
2. 水凝膠雜化材料的設計策略及異質特性,運用調整UV和37°C處理順序制備不同水凝膠、使用納米壓痕系統和流變儀測試力學性能、借助冷凍掃描電鏡觀察微觀結構等研究方法,探究不同成分對水凝膠力學性能和微觀結構的影響。結果表明,HA-MA和GMM濃度顯著影響水凝膠的有效楊氏模量等力學性能,GMMHM形成了內部致密、外部松散的交聯結構,其孔隙結構與力學性能密切相關。
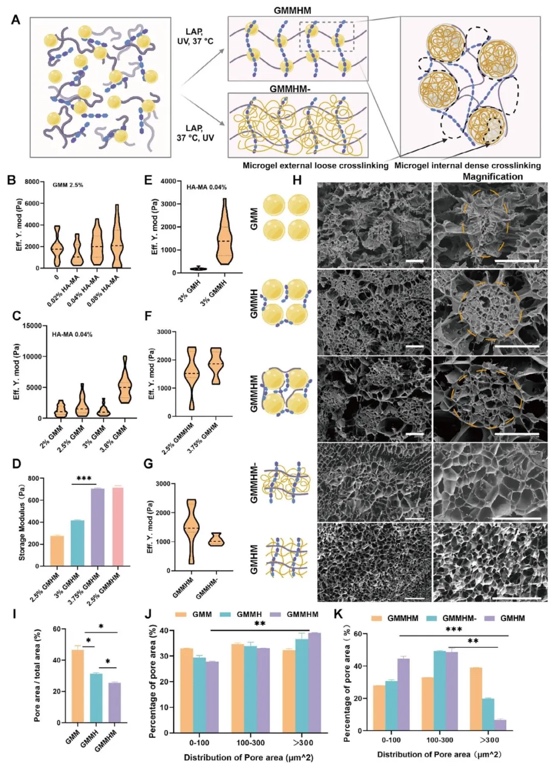
3. 嵌入式打印構建宏觀血管并進行直接血管吻合,利用振蕩剪切流變儀測試材料流變特性、進行嵌入式3D打印實驗及動物血管吻合手術的研究方法,研究GMMHM用于構建宏觀血管網絡及與宿主血管直接吻合的可行性。結果表明,GMMHM具有良好的剪切變稀和自愈合特性,可成功打印復雜血管結構并實現與大鼠頸動脈和頸靜脈的直接血管吻合,保證植入后組織穩(wěn)定。
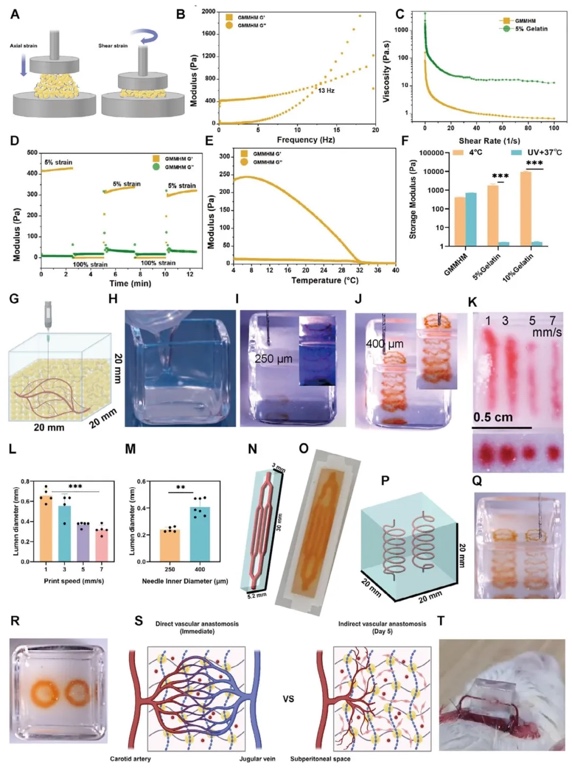
4. 3D打印結構中的初步血管生成和血管發(fā)生,采用細胞培養(yǎng)、免疫熒光染色、掃描電鏡觀察和定量分析等研究方法,研究GMMHM對內皮細胞自組裝形成微血管網絡的影響。結果表明,GMMHM能促進血管生成和血管發(fā)生,形成復雜的微血管網絡,且該過程依賴于基質金屬蛋白酶(MMP)對水凝膠網絡結構的降解。
5. 支持間充質干細胞和實質細胞活性,通過將不同細胞類型封裝在GMMHM和GMMHM−中培養(yǎng)并檢測細胞活性、代謝功能等研究方法,研究GMMHM對多種細胞活性和功能的支持作用。結果表明,GMMHM具有良好的生物相容性,可促進間充質干細胞(MSCs)、人臍靜脈內皮細胞(HUVECs)等細胞的生長和擴展,支持原代人肝細胞(PHHs)和胚胎干細胞分化的心肌細胞的功能。
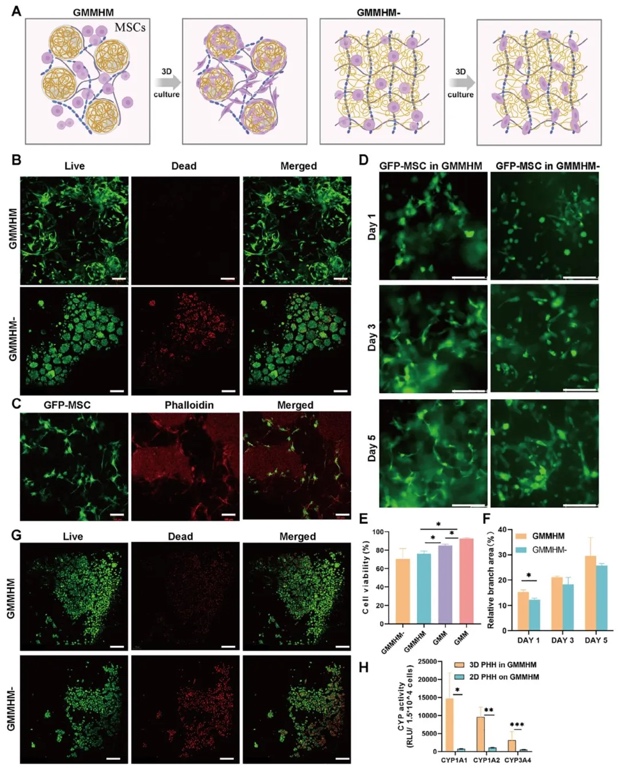
6. 優(yōu)化3D空間構建高細胞密度組織模型,運用分析不同細胞密度對水凝膠機械性能影響、調整水凝膠成分構建組織模型等研究方法,研究如何優(yōu)化水凝膠以構建高細胞密度(HCD)組織模型。結果表明,通過調整GMMHM中微凝膠和生物大分子比例,可實現高細胞密度且保證水凝膠具有適宜機械性能和生物相容性。

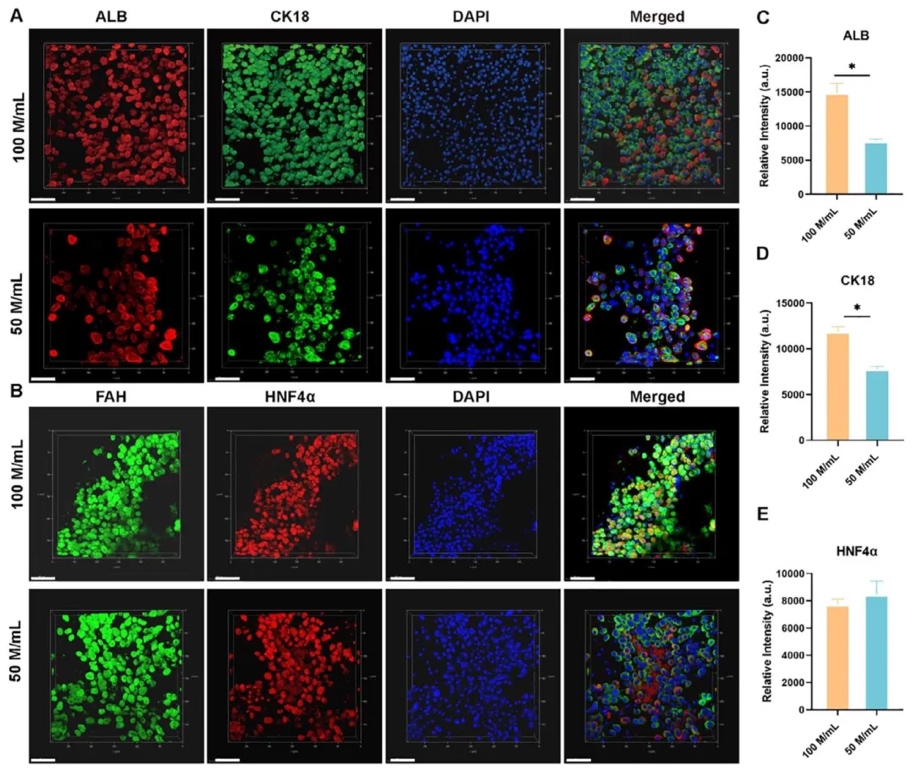
7. 細胞密集型水凝膠雜化材料促進肝功能,通過免疫染色、定量聚合酶鏈反應(qPCR)檢測肝相關蛋白和基因表達等研究方法,研究HCD的肝細胞在GMMHM中培養(yǎng)后的肝功能。結果表明,高細胞密度能增強肝組織功能相關蛋白和基因的表達,且添加黃原膠(XG)可改善GMMHM構建宏觀血管的生物打印性能。
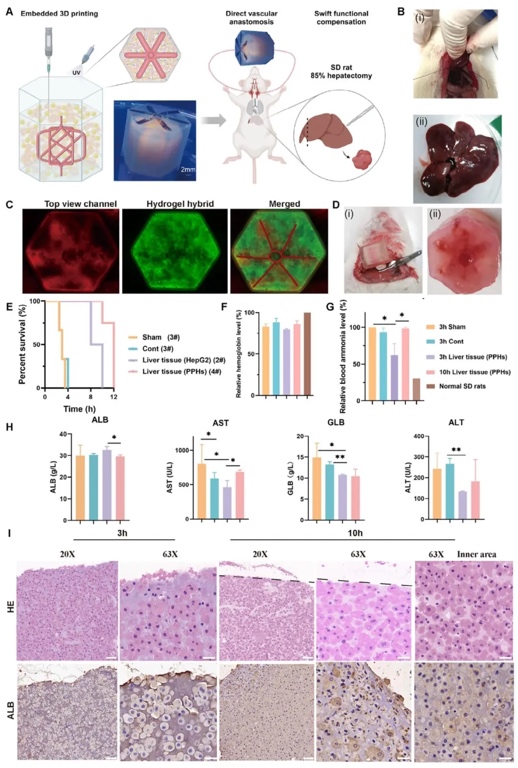
8. 工程化血管化肝臟對SD大鼠的快速功能支持,借助建立大鼠肝衰竭模型、植入工程化肝組織并進行血液生化分析等研究方法,研究工程化血管化肝組織對急性肝衰竭SD大鼠的治療效果。結果表明,植入含高細胞密度肝細胞的工程化肝組織可延長大鼠存活時間,改善肝功能指標,降低血清氨水平。
研究結論
本研究開發(fā)了一種具有異質微環(huán)境的微凝膠-水凝膠雜化材料,它利用化學交聯和物理纏結來調控基質剛度和孔隙結構。該雜化材料不僅能在體外支持多種細胞的形態(tài)發(fā)生和功能活動,還具備工程組織所需的機械性能,可實現直接血管吻合,促進體內快速功能補償。通過將血管生成、血管發(fā)生與嵌入式3D打印相結合,在厚組織內構建了復雜的微血管網絡和宏觀血管通道。增強的機械性能使雜化材料能與宿主血管直接吻合,減少連接時間,降低厚組織壞死風險。通過調整微凝膠與生物大分子的比例,本研究在體外構建了高細胞密度的高度血管化肝組織模型,并成功植入急性肝衰竭的SD大鼠體內,實現了快速血液灌注和肝功能恢復,為構建具有獨特理化性質的血管化組織提供了新方法。
文章來源:
https://doi.org/10.1002/adma.202413940
(責任編輯:admin)


 從齒科到微納:普利生3D打
從齒科到微納:普利生3D打 Nature子刊:中佛羅里達大
Nature子刊:中佛羅里達大 通過冷噴涂增材制造,實現
通過冷噴涂增材制造,實現 休斯頓大學開發(fā)用于生物醫(yī)
休斯頓大學開發(fā)用于生物醫(yī) 等離子束金屬3D打印大型無
等離子束金屬3D打印大型無 3D生物打印構建內
3D生物打印構建內 《Small Science
《Small Science 南洋理工-劍橋大
南洋理工-劍橋大 清華大學:抗拉強
清華大學:抗拉強 《Science》:一
《Science》:一 國產大尺寸陶瓷3D
國產大尺寸陶瓷3D

